
2022/09/15

高市 新型コロナウイルス感染症に対しては、私は、常々、お亡くなりになる方の数と重症患者数を最小化することが重要だと提唱してきました。振り返れば、2020年に国内で初めて確認されたときに、私は、経済安全保障を強く意識しました。最初のころは、マスクの7割が中国で製造されているなど、多くの国民の皆さん、私たち国会議員も全く知りませんでした。すぐにマスクや消毒液が不足し、注射器や医療用ガウン、さらには人工呼吸器も不足するなどいろいろなことが起こりましたよね。こうした状況においては、まず一刻も早く、日本でもしっかりと国産のワクチンが提供されなければいけないし、それから国産の治療薬を確保することがとても大事だと考えています。
池野 中外製薬の奥田社長、今の高市政調会長のお話を伺ってどのように思われましたか。
奥田 中外製薬で社長CEOを務めている奥田修です。今回の新型コロナウイルスに関しては、患者さん、国民の皆さんが、ワクチンや治療薬などにしっかりとアクセスできること、それを使えるような状況になることの重要性が改めて認識された機会になったと考えています。
当社の治療薬への取り組みについて申し上げますと、最初は、コロナという病態が、よく分からなかったので、まずは、できるところからスタートしました。そして、軽症から中等症、重症、さまざまな症状に合わせた治療薬、複数のオプションが必要だということが分かってきました。高市政調会長がおっしゃった通り、新型コロナウイルスに関しては、重症化を抑制することと死亡者を少なくすることがすごく重要になるのですが、そのためには、軽症あるいは中等症の段階から重症化を防ぐ必要があります。このような対応をしていても、重症になる患者さんがどうしてもおられるので、それぞれの状態に応じた治療薬、いわば複数のオプションを開発していくことがわれわれ製薬会社に求められることだと考えています。
当社は、コロナが始まった20年3月中旬に、中国からの「IL -6の機能を阻害する関節リウマチなどの治療薬『アクテムラ』を使うとコロナの重症化患者の死亡を下げる可能性がある」との報告をきっかけに、グローバルレベルで戦略的アライアンスを結んでいるスイスの医薬品メーカー、ロシュと共同して「アクテムラ」の臨床試験を開始しました。最初は、患者さんがどういうタイミングで「アクテムラ」を使えば、どのような効果が出るのか分からない中、手探りで臨床試験をせざるを得ない難しい状況でした。しかし、昨年、アメリカで緊急使用許可をいただき、日本でも今年の初めに適応追加承認をいただくことができました。今では、世界中の数多くの患者さんに「アクテムラ」を使っていただき、酸素投与を要する肺炎患者さんの治療に貢献できたと自負しています。
高市 私も創薬の重要性を改めて実感しました。
奥田 新型コロナに関し、当社が貢献できたもう一つの実績としましては、抗体カクテル療法「ロナプリーブ」の提供です。これは「リジェネロン」というアメリカの会社が開発した薬剤なのですが、20年11月にアメリカでは緊急使用許可になっています。そこから8カ月後、21年7月には日本で特例承認をいただきました。去年の7月を思い返していただくと、デルタ株が感染拡大のタイミングでしたが、そのタイミングに何とか間に合って、患者さんに薬剤を届けることができたわけです。これは軽症と中等症1の患者さんを対象にしていますので、重症化も防ぎ、結果的に医療提供体制の逼迫を軽減することに貢献できたと考えています。
池野 「ロナプリーブ」も貴社とロシュの戦略的アライアンスというスキームが活用されているのでしょうか。
奥田 その通りです。「ロナリーブ」は、アメリカ以外ではロシュが開発・販売していますが、同社との戦略的アライアンスに基づくライセンス契約により、日本での権利を当社が持っているため、日本で開発して患者さんに届けることができたわけです。
高市 ご指摘の通り、医薬品開発は、国民の皆様の命を守る重要事項です。従って、私は、研究開発支援を、国が前面に立って行うべきだと考えています。
現在、来年度に向けて、概算要求の基本方針を決定する大詰めの段階を迎えています。これから年末に向けて、各省庁別の予算の規模が決まっていくわけですが、科学技術の研究開発費、特に製薬産業に関しては、国が相当支援をしなければならないと思います。アメリカ国立衛生研究所(NIH)とわが国の国立研究開発法人「日本医療研究開発機構」(AMED)の研究資金を比較すると、22倍もの差があり、これは経済安全保障の課題そのものと言えるでしょう。さらに、私は、資金配分の仕方にも問題意識を持っています。日本の現状は、文部科学省、厚生労働省、経済産業省からAMEDとインハウスの研究所に行って、そこからようやく臨床研究の中核病院や大学、研究所に渡る仕組みですが、早急に改善すべきでしょう。なぜなら、これは、国が直接やるべき危機管理投資で、まさに発想の大転換が必要です。仮に、国内で生産できると多くの方の命も救えると同時に、海外にも輸出できる成長投資にもなるからです。
奥田 私も、日米のライフサイエンス分野における政府研究開発支出の差が非常に大きくなってしまっている現状を心配しています。と言いますのも、コロナ禍以前から、アメリカは、国防の費用としても、バイオベンチャーをはじめ、医薬品の基礎技術にしっかりお金を出しています。そうした積み重ねがあったからこそ、それまでがん研究で進められてきたmRNA(メッセンジャーRNA)がコロナワクチンに使えるとなったときに、生産体制の強化や臨床試験への資金投入などが行えたと見ています。

池野 実に興味深いお話です。高市政調会長は、日本の医薬品メーカーの特徴をどのように捉えておられますか。
高市 グローバルマーケットの中で、上位25社に、日本は売上げ規模では3社、時価総額でも3社という状況でした。私自身は、日本の中で必ずしもメガファーマが増える必要はないと認識していまして、中外製薬や第一三共などは、フォーカスした研究開発を進めています。つまりわが国の医薬品産業の発展のためには、こうしたスペシャリティファーマがしっかりと増えていくというのが大事なんだろうなと思っています。具体的には、中外製薬の場合、特化型や難病対策の治療薬としての抗がん剤、それから免疫系の病気、まさに「アクテムラ」なども手掛けておられますね。
ただ、全体的に見て気になるのは、日本の医薬品メーカーは、昨今のニーズである高分子薬、バイオへの切替えが少し遅れているのではないかなという印象は持っています。
池野 では奥田社長に伺いますが、先ほどのご説明によると、アメリカは、時間軸も含めた総合的な「創薬エコシステム」が既に構築されているということになりますね。
奥田 その通りです。今後、新型コロナ以降を見据えた場合、別のウイルスなどがまん延するリスクも想定されますので、わが国においても「創薬エコシステム」を構築しておくことが、極めて重要になってくるでしょう。
また、今回新型コロナで、日本の医薬品メーカーがワクチンや治療薬の供給で時間的な遅れをとってしまった理由として、国内でのワクチンやバイオの生産拠点があまりなかったという事情にも触れておきたいと思います。例えば、アメリカやドイツのバイオベンチャーが「ワクチンや治療薬を創りました」と言っても、生産する場所がないと、実際にはなかなか供給できません。もし、日本に生産拠点があれば、例えばアメリカやドイツ企業とのコラボなどを国主導でやっていただくことで、すぐに生産を開始して、日本の患者さんに迅速に届けることが可能になります。
高市 奥田社長のお話を伺っていて、やはり特定領域にフォーカスした技術をどのように蓄積して実用化していくのかが大切になると再認識しました。通常、こうした技術は、スタートアップやアカデミアが持っていますので、その存在感は年々増しています。従って、世界的には、水平分業がもう潮流になっていると思うのです。
医薬品メーカーの強みとは、薬事とか薬価、知的財産などの制度に精通しているということと、製造も流通も含めて品質をきちんと確保できることでしょう。スタートアップは、なかなかそうもいきませんので、協業していく仕組みを構築することが大事だと感じました。
それから、奥田社長から、国防と医薬品開発にまつわる、とても心に響くご説明がありました。確かに、アメリカの場合、国防、軍事関係の研究から民生で生かせるものがどんどん生まれています。古くは電子レンジ、インターネットをはじめ、恐らく化学兵器対応なども含めて、薬に関する研究もしっかりと予算がついているのでしょう。残念ながら、日本では、ようやく日本学術会議がデュアルユースの研究を認める旨を発表したばかりです。これまでは、健康などに使える技術を防衛にも使おうとすると、「学長の許可が出ないと、活用することすらできない」という非常にばかばかしいことがあったのですが、徐々に改善されている状況です。

高市 それから政治的に厳しいテーマというのは、薬価制度と国民皆保険制度をどう両立させていくかという点ですね。国民皆保険制度が、とても良い制度であることは言うまでもないのですが、医薬品メーカー側から見ると一定量の需要は確実に見込めるという安心感はあるものの、革新的な薬剤に対する見返りは非常に少ないという面もあるのかなと案じています。
率直に、私が医薬品メーカーは大変だなと思うのは、新しい薬を開発しようと思ったら、何千億円というお金がかかると同時に、10年ぐらいの時間もかかる、と。成功率は2万3000分の1と聞いていますので、莫大な資金と年月が必要なわけですね。
あくまで私の個人的な考えですが、国民皆保険はしっかり維持しながら、保険適用の薬も徐々に増やしていき、革新的な研究開発には、危機管理投資として別の予算枠で、国が思い切って研究開発支援をしていくべきではないか、と。
池野 アメリカのように民間保険が主導のところと違って、国民皆保険制度の場合、ある程度、一定のバジェットがあって、その中から出していかなければいけないとなると、薬価が、2年に1回落ちていくという事情は、すごく理解はできますよね。
ただ、現状としてバイオ医薬品などが強くないと、海外からの輸入を余儀なくされてしまうということになります。すると、「日本に行く価値がない」、行っても導入コストがかかって、「結局、薬価が低いのでペイしない」ということで、いわゆる「ドラッグ・ロス」という問題が起きるのではないかと懸念しています。
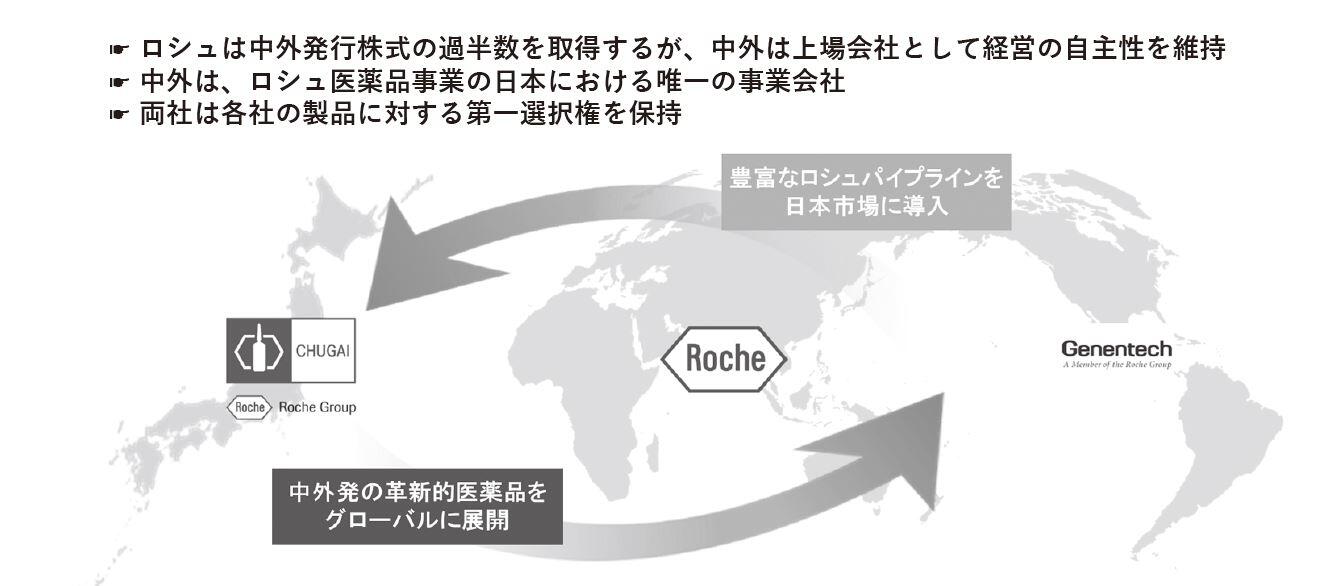
池野 私が、中外製薬を素晴らしいと感じる点は、スイスの医薬品メーカー、ロシュと戦略アライアンスを上手に組まれていることです。私は、医者という視点で、人の命を救うためには、薬や医療機器の国籍は関係ないと思っています。良いものであれば、アメリカ製であろうと、日本製であろうが、問題ありません。むしろ、一早く導入することがすごく重要なんですね。最初の事例で取り上げた「アクテムラ」は、もともとの基礎研究は大阪大学の免疫学からできたもので、それを中外製薬が薬として製品化し、全世界に流通させたわけです。ある意味、非常に数少ない日本の大学発の大ヒットとも言えるのですが、中外の立場だと、自分たちの薬をいかに早く世界展開するか、世界的ネットワークを活用するかがポイントだった。逆に、ロシュ、ジェネンテックなど提携している医薬品メーカーからすれば、自分たちの製品も日本国内にも入れることができるということで、いわゆるグローバルなオープンイノベーションを実践されている数少ない医薬品メーカーだと言えます。
奥田 ロシュとの戦略的アライアンスは、2002年より開始していますので、もう20年も前になります。現在、同社は、世界で第2位の製薬会社ですが、コロナ禍が始まる前には1位でした。当社は、ロシュが持つグローバルに開発する医薬品の日本での開発・販売権を持ち、当社が創り出す薬は、ロシュが持つグローバルの開発インフラ、販売インフラを通じて、世界の患者さんに届けられます。これが功を奏して、当社は新薬をより多く創れるようになりましたし、一方でより多くの新薬をロシュから導入して、日本の患者さんに届けられるようになりました。
池野 ロシュとの戦略的アライアンスは、創薬においても大きかったと言えるのでしょうか。
奥田 その通りです。同社の研究開発費は、ざっと1兆円です。先ほど高市政調会長がご指摘されたように、新薬一つの開発を成功させるには、ざっと3000億円かかります。時間も10~15年ぐらい平気でかかります。つまり、ある程度研究開発費を使える体力がないと、創薬は絵に描いた餅になります。ロシュは、その1兆円以上の研究開発費に使って、そこから生み出される新薬を日本で開発・販売する権利を当社が持って、日本の患者さんに届けます。また、届けると同時に、日本での売上げが当社に上がりますので、その売上げをベースに、当社は自らが創り出す新薬の研究開発に重点的に投資できるわけです。しかも、医薬品の研究開発は、創薬、研究の段階よりも、最後の臨床試験段階で非常にお金がかかるわけですが、そこもグローバル開発はロシュが担うことで、われわれは創薬、研究の段階にかなり集中して投資できるようになりました。
池野 なるほど、素晴らしいですね。
奥田 ここ20年間の推移を見ていると、「アクテムラ」も含め、5個の新しい薬を創ることができました。このうちグローバルに通用する薬も4個出せていますので、この点からもロシュとの戦略アライアンスは非常にうまくいっていると言えるでしょう。
高市 中外製薬とロシュのような戦略的アライアンスという事例を実際に伺えて非常に勉強になりました。また、医薬品メーカーに限らず、日本企業はこのスキームをもっと勉強し、横展開してもよいと感じました。なぜなら、株式の保有割合で言えば、ロシュが59%を超えていますよね。だけど、中外製薬の名前はそのままで、経営陣も独立しています。つまり、中外製薬の東証プライム上場にもロシュは貢献していると言えると思うのです。中外とロシュの両方で利益が出て、その利益がイノベーションにつぎ込まれているわけですから、こういったビジネスモデルをもう少し他の日本企業も考えていかなければならないし、政府もしっかりと情報共有する必要があるでしょうね。
池野 「わが国創薬力強化」に向けて、日本の医薬品メーカーに求められることとはどんなことだと思われますか。例えば、2021年度の売上げランキングで言うと、中外が世界ランキングで26位、武田薬品工業が世界11位に入ってきますが・・・。
高市 私は、スケールを求めるよりもやはり、危機管理投資としての国の大規模な支援と、「創薬エコシステム」の確立が必要だと今回の座談会を通じて再認識しました。
池野 岸田文雄内閣の成長戦略の柱に、人材とスタートアップがキーワードになっているのですが、奥田社長、医薬品メーカーの代表としてコメントをお願いできますか。
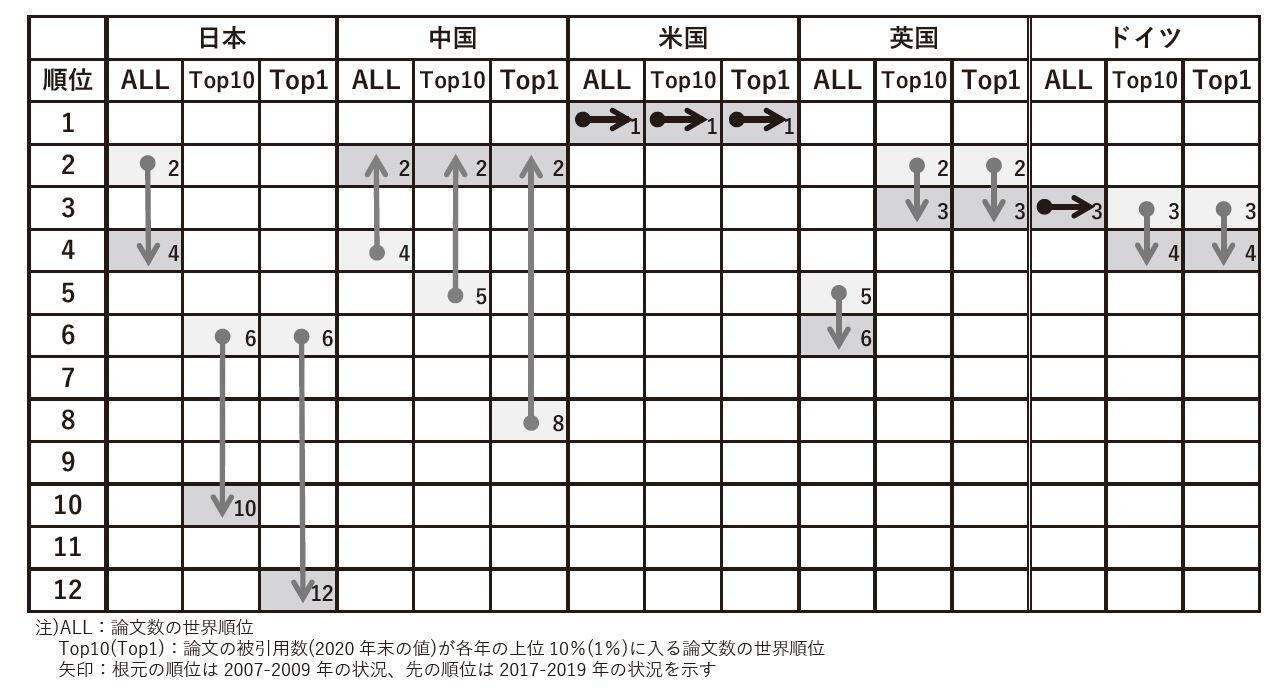
奥田 スタートアップは、創薬エコシステムの中で、非常に重要なプレーヤーだと思います。従って、彼らが生まれ出てくる環境を整えることはものすごく重要ですね。ただ、スタートアップが出てくる前に、医薬品ってどういうところから創られるのかというと、まずは、大学の基礎医学研究、具体的には生理学、生化学とか、分子生物学などからシーズが生まれてくるわけですよね。日本のそういう基礎医学研究のレベルはどうかというと、実は、少し前は、非常にレベルが高かったんですね。基礎生命科学分野における論文数のランキングを見ても、日本はアメリカに次いで2位の水準を保っていたんですが、最近、順位が下がっています。逆に、どこが強くなっているかというと中国で、次いでイギリス、ドイツが3位、4位ぐらいを保っています。
高市 私も臨床研究、論文数が少ないのは気になっていました。そもそも日本は、Ph.D.の人数が少ないですよね。学位を取得された後に製薬企業に就職する比率も、アメリカに比べると圧倒的に少ないです。結果、基礎研究から臨床研究までを一体的に行う橋渡し研究(トランスレーショナショナルリサーチ)が脆弱(ぜいじゃく)になってしまっています。
奥田 そうなんですよ。ですから、「創薬エコシステム」確立に向けて、どこに重点的に資源配分するかということが非常に重要だと思います。やはり、ベースにあるのは、大学や研究機関、いわゆるアカデミアの研究なので、そこに資源配分をすることが重要ですが、これは、成果が出るまでに時間がかかります。来年すぐに、何か成果が出てくるみたいなものではないので、「日本を創薬大国にするんだ、それに経済成長の一翼を担わすんだ」という強い信念を持って、かなり長期的な視野で資源配分していく必要があるでしょう。
それから、「創薬エコシステム」確立のためには、そこから出てくるバイオベンチャー、スタートアップを支援する「人」とモノと金が重要ですよね。特に、お金がなかなか回らないんですよ。スタートアップを政府が支援するのはもちろん大賛成ですが、ベンチャーキャピタル(VC)の資金力、資金供与額がアメリカと比較すると・・・。
高市 もう桁が違いますね。
奥田 はい。桁が違うんで、そこも何とかしたいですね。例えば、現在、経済産業省は、応援してくれていますので、さらにVCを増やしていく必要があります。
もう一つは「人」の資質の問題が挙げられます。つまり、バイオベンチャーを経営できる、ビジネスが分かる人材とサイエンスが分かる人材のコンビネーションがとても重要なんですよね。日本のバイオベンチャーを見渡してもなかなかそういう人材がいません。実のところ、育っていないというのが現状なのですが、その一つの理由が、人材の流動性だと思います。現実に、製薬会社からバイオベンチャーに行く人はそんなに多くないです。アカデミアからバイオベンチャーに行く人だってそんなにいません。これが、もう少し流動性が高まると、製薬会社の経験がバイオベンチャーに行ったり、バイオベンチャーの経験がアカデミアに行ったりします。こういう状況になると、徐々にバイオベンチャーの成功確率が高まってくるのではないかと見ています。
高市 今回は、奥田社長、池野先生と鼎談(ていだん)できて、本当に勉強になりましたし、非常に有意義でした。最後に、私からも申し上げてもよいですか。せっかくの機会ですから、多くの国民の方にご理解いただきたいことなんですが、例えば、医療機関で得られたさまざまなデータを、匿名性を持ってビッグデータとして活用することについてご理解とご協力をいただきたいということを改めてお伝えしておきたいと思います。私自身、2006年にイノベーション、科学技術、IT担当大臣を経験したこともあり、こうしたビッグデータの活用は、医学・薬学の発展にとても大きな進歩をもたらすと確信しています。ただ、わが国の場合、個人情報の取り扱いについて、どうしても神経質になってしまう傾向にあるので、これは国が中心になって、責任を持って、「個人名は流出しない、個人の健康情報が出るものではない」ということでご理解いただき、医学の発展にぜひご協力をいただきたいと思います。
池野 皆さん、今回はありがとうございました。
(月刊「時評」2022年9月号掲載)